我们的服务
Our service
日本厚生劳动省认证&PMDA评审
都需要提供日本厚生省的卫生证明。
日本医疗器械分类及监管方式
高度管理医疗器械(Ⅲ类、Ⅳ类)、管理医疗器械(Ⅱ类)、一般医疗器械(Ⅰ类)。根据2013年11月开始实施的《药事法》,日本医疗器械按照产品的风险等级由低到高,分别采取产品备案、第三方认证和厚生劳动省(简称厚生省)承认监管方式
审查业务旨在控制风险,是上市前对产品安全有效性的审核,主要职能包括临床试验等相关咨询工作;对药品、医疗器械和再生医疗产品的审查、再审查/再评价;对申请资料等相关内容可靠性调查(GCP/GLP/GPSP符合性评估);对生产企业的GMP/QMS/GCTP检查;对注册认证机构的检查;日本药典等标准的编写与调查等。
安全对策业务是指上市后的安全措施,旨在持续性降低风险,是PMDA与厚生省一同协作,为了保证医疗器械的安全、放心使用而实施。PMDA与厚生省从制造商、经销商、医疗机构等处收集与医疗器械产品质量、有效性、安全性相关的信息,并对收集的信息进行科学的调查、探讨,形成安全应对策略。根据各项规定要求,在PMDA官网上不仅可以查到审查相关的资料,同时可以查到紧急安全性信息、关于医疗安全信息的通知等。
在PMDA中进行审评的医疗器械分为以下三类:
首先是新医疗器械,是与已批准的医疗器械在结构组成、使用方法、效果及性能方面有明显差异的医疗器械。
其次是改良医疗器械,即不属于新医疗器械或仿制医疗器械的医疗器械。
第三是仿制医疗器械,是被认为与已批准的医疗器械在结构组成、使用方法、功能、效果及性能等方面有等同性的医疗器械,即与已批准医疗器械在构造、使用方法、效果及性能本质上等同的产品,申请认证或承认时不需要提供临床试验数据。
新医疗器械与改良医疗器械一般无相应的审查标准,无论风险等级为Ⅱ、Ⅲ还是Ⅳ级,均由PMDA进行审评,厚生省承认。自2009年起,对于已有审查标准的仿制医疗器械,可由第三方认证机构认证;无审查标准的仿制医疗器械仍由PMDA审评,厚生省承认。
日本医疗器械获得承认的流程见图
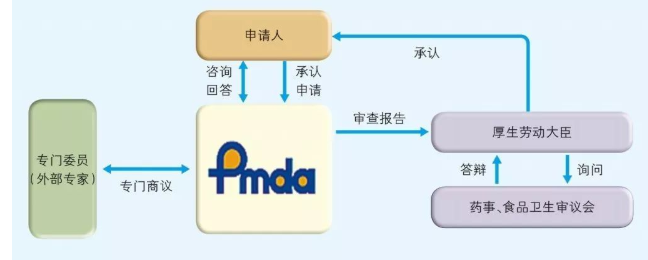
专门委员由PMDA从各学科中经验丰富者中选出并任命,名单在PMDA网站公布。与专门委员商议的制度有信函商议和会议商议两种方式,会议商议与我国医疗器械技术审评中心的专家咨询制度类似。
炜烨检测现已开通日本渠道
可以直接开展厚生省认证业务
欢迎新老客户咨询!
咨询热线(微信同号)15507598097 吴